Bienvenidos a mi post. En esta oportunidad quería aportar algo a la comunidad que le pueda servir a aquellos que estén en primer año de ingeniería como yo (Ingeniería en Telecomunicaciones) y necesiten apoyo en química inorgánica. Creo yo que es una de las cosas más importantes de la materia, ya que sin saber la nomenclatura de los elementos químicos, trabajar en un laboratorio sería complicado.
Estudio de la Tabla Periódica
En 1869, el químico ruso Dimitri Mendeleev y el químico alemán Lothar Meyer publicaron en forma independiente ordenamientos periódicos de los elementos.
Dmitri Mendeleev
La clasificación de Mendeleev se basó en las propiedades químicas, mientras que la clasificación de Meyer se basó en las propiedades físicas.
Lothar Meyer
Las tabulaciones eran sorprendentemente semejantes, y en ambas se destacaba la periodicidad, o repetición periódica regular, de las propiedades en concordancia con el incremento de la masa atómica
Mendeleev ordenó los 62 elementos conocidos en 1872, de forma tal que aquellos con propiedades físicas y químicas semejantes ocupaban la misma columna.
Primer tabla de Mendeleev de 1872
Los elementos estaban ordenados por sus masas atómicas crecientes y agrupados en familias verticales.
Donde se dio cuenta que ''faltaban'' elementos, Mendeleev dejó espacios vacíos, pronosticando la existencia de elementos aún desconocidos.
Debido a que el ordenamiento de los elementos de Mendeleev se basó en masas atómicas crecientes, algunos elementos estaban fuera de sitio.
La explicación a los elementos ''fuera de sitio'', tuvo que esperar el desarrollo del concepto de número atómico, casi 50 años después del trabajo de Mendeleev.
El número atómico de un elemento, representa el número de protones presentes en el núcleo del átomo. (El número de protones es igual al número de electrones en un átomo neutro). Esta definición resulta crucial para la identidad de cada elemento, ya que tiene relación con la estructura eléctrica de los átomos.
Actualmente, los elementos están ordenados en base a su número atómico creciente y debido al desarrollo de este concepto, la ley periódica adquiere su forma actual
Las propiedades de los elementos son funciones periódicas de sus números atómicos.
Metales Alcalinos
Los metales alcalinos son aquellos que están situados en el Grupo 1A de la tabla periódica (excepto el Hidrógeno que es un gas).
Propiedades:
* Son metales muy reactivos, por ello se encuentran siempre en compuestos como óxidos, haluros, hidróxidos, silicatos, etc. y nunca en estado puro
* Son metales blandos, pueden ser rayados con facilidad.
* Tienen un gran poder reductor; de hecho, muchos de ellos deben conservarse en aceite mineral para que su elevada reactividad no haga que reaccionen con el oxígeno o el vapor de agua atmosféricos.
Metales Alcalinotérreos
Los metales alcalinotérreos son aquellos que están situados en el Grupo 2A de la tabla periódica
Propiedades:
* Son metales de baja densidad, coloreados y blandos.
* Reaccionan con facilidad con halógenos para formar sales iónicas, y con agua (aunque no tan rápidamente como los alcalinos) para formar hidróxidos fuertemente básicos
Metales de Transición
* Estructura compacta.
* Puntos de ebullición y de fusión altos.
* Forman compuestos de coordinación con facilidad.
* Suelen exhibir más de un estado de oxidación estable.
* Muchos de sus compuestos son coloreados.
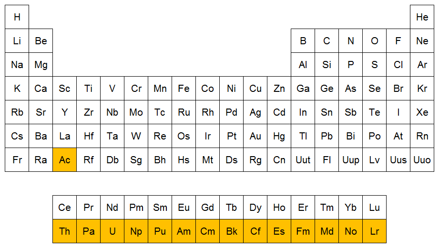
Lantánidos
Son un grupo de elementos que forman parte del Período 6 de la tabla periódica
Propiedades:
* Estos elementos son llamados tierras raras y también, junto con los actínidos, elementos de transición interna.
* El nombre procede del elemento químico lantano, que suele incluirse dentro de este grupo.
* En total son 15 elementos, desde el de número atómico 57 (el lantano) al 71 (el lutecio).

Actínidos
Los actínidos son un grupo de elementos que forman parte del Período 7 de la tabla periódica.
Propiedades:
* Estos elementos, junto con los lantánidos, son llamados elementos de transición interna. El nombre procede del elemento químico actinio, que suele incluirse dentro de este grupo, dando un total de 15 elementos, desde el de número atómico 89 (el actinio) al 103 (laurencio).
* Estos elementos presentan características parecidas entre sí. Los de mayor número atómico, no se encuentran en la naturaleza y tienen tiempos de vida media cortos; todos sus isótopos son radiactivos.
* En la tabla periódica, estos elementos se sitúan debajo del resto, junto con los lantánidos.
No Metales
Los elementos que compones el bloque de los No Metales son:
• Carbono,
• Nitrógeno,
• Fósforo,
• Oxígeno,
• Azufre,
• Selenio.
• El grupo de los halógenos y los gases nobles
Metaloides
Los metaloides exhiben algunas propiedades que son características tanto de los metales como de los no metales.
* Los elementos que compones el bloque de los metaloides son:
• Boro
* Silicio (semiconductor)
* Germanio (semiconductor)
* Antimonio (semiconductor)
• Arsénico
• Telurio
• Polonio
• Astato
*(Importantes en circuitos electrónicos de estado sólido) son aislantes a bajas temperaturas (T), pero se vuelen conductores a altas T. En contraste, la conductividad de los metales baja con el aumento de T (ºC)
Halógenos
Los Halógenos son aquellos que están situados en el Grupo 7A de la tabla periódica.
Propiedades:
* Son elementos volátiles, diatómicos y cuyo color se intensifica al aumentar el número atómico
* El Flúor es un gas de color amarillo pálido, más pesado que aire, corrosivo y de olor penetrante e irritante.
* El Cloro es un gas amarillo verdoso de olor penetrante e irritante

* El Bromo a la temperatura ambiente es un líquido de color rojo oscuro, 3 veces más denso que el agua, que se volatiliza con facilidad produciendo unvapor rojizo venenoso.
* El Yodo es un sólido cristalino a temperatura ambiente, de color negro y brillante, que sublima dando un vapor violeta muy denso, venenoso, con un olor picante como Cl.

Gases Nobles
Los Gases Nobles son aquellos que están situados en el Grupo 8A de la tabla periódica.
Propiedades:
* Bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja.
* Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica: a su capa electrónica de electrones de valencia se la considera completa.
* Otorgándoles poca tendencia a participar en reacciones químicas, por lo que sólo unos pocos compuestos de gases nobles han sido preparados.
Soluciones Acuosas
Casi ¾ partes de la corteza terrestre están cubiertas con agua y los líquidos corporales de todas las plantas y animales se componen de agua. En consecuencia, es fácil observar que muchas reacciones químicas tienen lugar en solución acuosa.
Antes de hacer un estudio sistemático de las reacciones químicas, es útil saber que tipos de sustancias son solubles en agua.
1. Electrolitos y grado de ionización.
Los solutos solubles en agua pueden clasificarse como electrolitos y no electrolitos.
Los electrolitos son sustancias cuyas soluciones acuosas conducen la corriente eléctrica.
Los electrolitos fuertes son sustancias que conducen bien la electricidad en soluciones acuosas diluidas.
Los electrolitos débiles son malos conductores de la electricidad en soluciones acuosas diluidas.
Los no electrolitos son sustancias que no conducen la corriente eléctrica.
El movimiento de los iones conduce la corriente eléctrica a través de la solución acuosa.
La fuerza de un electrolito depende del número de iones en solución y también de la carga de los iones.
La disociación es el proceso por el cual un compuesto iónico sólido como el NaCl, se separa en sus iones en solución:
Los compuestos moleculares, por ej. HCl puro, existen como moléculas discretas y no como iones. Sin embargo, muchos de estos compuestos forman iones en solución:
La ionización es el proceso por el cual un compuesto molecular
se separa o reacciona con el agua para formar iones en solución.
Tres tipos importantes de solutos son electrolitos fuertes:
1. Ácidos fuertes,
2. Bases fuertes,
3. Casi todas las sales solubles.
Estos compuestos están totalmente ionizados (o disociados) en solución acuosa, por eso son electrolitos fuertes.
Un ácido se define como una sustancia que produce iones hidrógeno H+, en solución acuosa.
Una base se define como una sustancia que produce iones oxhidrilos OH–, en solución acuosa.
Una sal se define como un compuesto que tiene un catión diferente a H+ y un anión diferente al ion OH–, o el ion óxido, O^-2
2. Ácidos fuertes y débiles.
Por conveniencia clasificamos los ácidos en ácidos fuertes y ácidos débiles.
Los ácidos fuertes se ionizan (se separan en iones hidrógeno y aniones estables) por completo en solución acuosa.
Debido a que los ácidos fuertes se ionizan totalmente en solución acuosa diluida, sus soluciones contienen iones.
Los ácidos débiles se ionizan muy poco en solución acuosa diluida
La flecha doble significa que la reacción tiene sentido en ambas direcciones (reacción reversible) y que la reacción directa no llega a ser completa.
3. Reacciones reversibles.
Las reacciones que pueden ocurrir en ambas direcciones son reacciones reversibles.
En agua, todos los iones H+, CH3COO– se combinan para formar moléculas no ionizadas de HCH3COO. Por lo tanto, la ionización del ácido acético, como la de cualquier electrolito débil es reversible.
4. Bases fuertes, débiles e insolubles: Casi todas las bases son
hidróxidos metálicos iónicos.
Las bases fuertes son solubles en agua y están disociadas por
completo en solución acuosa.
Una base débil son solubles en agua, ionizándose ligeramente para producir una solución alcalina.
Una base insoluble está formada por hidróxidos iónicos, tan poco solubles en agua que no pueden producir soluciones básicas fuertes: Cu(OH)2, Zn(OH)2, Fe(OH)3.
5. Reglas de solubilidad de compuestos en solución acuosa.
Los compuestos cuya solubilidad en agua no supera 0,02 mol/L suelen denominarse insolubles.
Los compuestos cuya solubilidad en agua supera 0,02 mol/L se denominansolubles, junto con:
Reacciones en Solución Acuosa
Infinidad de reacciones químicas tienen lugar en solución acuosa. Entonces, ¿cómo escribir ecuaciones químicas que describan reacciones químicas en solución acuosa?
1. En las ecuaciones de unidades formulares, escribimos las fórmulas completas de todos los compuestos:
2. En las ecuaciones iónicas totales, las fórmulas se escriben para mostrar la forma (predominante) en que existe cada sustancia cuando está en solución acuosa.
3. En las ecuaciones iónicas netas, sólo se escriben las especies que reaccionan; la ecuación iónica neta resulta de eliminar los iones que no participan en la reacción:
El siguiente diagrama de bloques, ayuda a decidir qué unidades formulares de una ecuación iónica total tienen que escribirse como iones separados y cuales como unidades formulares sin cambio.
1. ¿Se disuelve en H2O? Si no escriba la fórmula completa.
2. (a) Si se disuelve, ¿se ioniza? → ácido fuerte.
(b) Si se disuelve, ¿se disocia? → base fuerte o sal soluble.
Si la respuesta es SI a cualquiera de las opciones de la segunda pregunta, la sustancia es un electrolito fuerte soluble y su fórmula se escribe en forma iónica.
Número de Oxidación
Las reacciones que comprenden transferencia de electrones de una especie a otra reciben el nombre de reacciones de óxidoreducción, o simplemente reacciones rédox.
Utilizamos números de oxidación para detectar la transferencia de electrones. Un compuesto está correctamente formulado si la suma de los estados de oxidación es cero.
El número o estado de oxidación (e.o) de un elemento, representa el número de electrones que gana o pierde un átomo de ese elemento cuando forma el compuesto.
En el caso de un ion de un solo átomo, el e.o. corresponde a la carga real del ion.
En las especies moleculares, los e.o. se asignan según algunas reglas arbitrarias; al elemento que está más a la derecha y arriba en la tabla periódica se le asigna un número de oxidación negativo. Al elemento que está más a la izquierda y abajo, se le asigna un número de oxidación positivo.
Clasificación de las Reacciones Químicas
Las reacciones químicas pueden clasificarse en:
1. Reacciones de oxidación-reducción.
2. Reacciones de síntesis.
3. Reacciones de descomposición.
4. Reacciones de desplazamiento.
5. Reacciones de metátesis (o de intercambio).
1. Reacciones de Óxido-Reducción
Las reacciones en las que hay transferencia de electrones entre los reactivos, se denominan reacciones de oxidación-reducción o redox.
Son las que se producen con cambios en los números de oxidación de los átomos.
Cuando un átomo, ion o molécula adquiere una carga más positiva (es decir, cuando ha perdido electrones) se oxida.
A la pérdida de electrones que experimenta una sustancia se le llamaoxidación.
Cuando un átomo, ion o molécula adquiere una carga más negativa (ha ganado electrones) se dice que se reduce.
A la ganancia de electrones que experimenta una sustancia se le llamareducción.
Cuando un reactivo pierde electrones (se oxida), otro reactivo debe ganarlos (se reduce).
La oxidación de una sustancia siempre va acompañada de la reducción de otra, cuando los electrones se transfieren entre ellas.
Ejemplo Cu + AgNO3
* Introducimos un electrodo de cobre en una disolución de AgNO3
* De manera espontánea el cobre se oxidará pasando a la disolución como Cu2+.
* Mientras que la Ag+ de la misma se reducirá pasando a ser plata metálica.
2. Reacciones de Síntesis
Las reacciones en las cuales se combinan dos o más sustancias para formar un compuesto se denominan reacciones de síntesis. Comprenden la combinación de:
a) Elemento + elemento = compuesto
Cada elemento pasa de un estado no combinado (e.o. = 0) a un estado combinado en un compuesto (e.o. ≠ 0). En consecuencia, las reacciones de este tipo son de óxido-reducción.
Los elementos de los grupos 1A y 2A se combinan con los no metales del 7A.
Cuando un no metal reacciona con exceso de otro no metal se genera un e.o. alto.
b) Compuesto + elemento = compuesto
El fósforo en e.o. +3, cloro se convierte al e.o. +5 cuando el PCl3 reacciona con más cloro para formar PCl5.
c) Compuesto + compuesto = compuesto
Un ejemplo de las reacciones de esta categoría, es la combinación de óxido de calcio con dióxido de carbono para dar carbonato de calcio:
3. Reacciones de Descomposición
Las reacciones de descomposición son aquellas en las cuales un compuesto en presencia de temperatura, se descompone para dar: dos elementos; uno o más elementos y uno o más compuestos ó dos o más compuestos.
Algunos óxidos metálicos, como el óxido de mercurio (II) se descomponen por calentamiento para producir oxígeno.
Los cloratos de metales alcalinos se descomponen cuando se calientan para producir cloruros y desprendimiento de oxígeno.
La descomposición térmica de la caliza produce un óxido metálico y dióxido de carbono.
4. Reacciones de Desplazamiento
Las reacciones en las cuales un elemento desplaza a otro de un compuesto, reciben el nombre de reacciones de desplazamiento.
Éstas, son siempre reacciones rédox. La reacción de un metal, ya sea con un ácido o una sal metálica se ajusta al siguiente patrón general:
El ion en disolución es desplazado o sustituido por un elemento que se oxida.
Muchos metales experimentan reacciones de desplazamiento con ácidos, y producen sales e hidrógeno gaseoso.
Por ej., el magnesio metálico reacciona con ácido clorhídrico para formar cloruro de magnesio e hidrógeno gaseoso.
El aumento en el e.o. del magnesio indica que el átomo ha perdido electrones, y que por lo tanto, se ha oxidado.
El ion H+ del ácido disminuye en su e.o. lo que indica que este ion ha ganado electrones y que, por lo tanto, se ha reducido.
Otro ej. el hierro metálico se oxida en solución acuosa de Ni(NO3)2
La oxidación de Fe para formar Fe+2, está acompañada por la reducción del Ni+2 a Ni.
Serie de Actividad de Metales en Solución Acuosa
Los distintos metales varían en cuanto a la facilidad con que se oxidan. Por ej, el Zn se oxida en soluciones acuosas de Cu2+, pero la Ag no. Por lo tanto, el Zn pierde e– más rápidamente que la Ag; es decir, es más fácil que se oxide el Zn que la Ag.
A la lista de metales organizados en orden decreciente de su facilidad de oxidación se lo conoce como serie de actividad.
Cualquier metal de la lista puede ser oxidado por los iones de los elementos que se encuentran debajo de él.
5. Reacciones de Metátesis
En muchas reacciones entre dos compuestos en solución acuosa, los iones positivos y negativos ―cambian de ''pareja'' para formar dos compuestos nuevos, sin cambio de estado de oxidación; estas reacciones reciben el nombre de reacciones de intercambio o metátesis (“transponer”).
En estas reacciones se eliminan iones en solución. Esta eliminación puede ocurrir de varias formas, las cuales sirven para clasificar estas reacciones:
1. Formación predominante de moléculas no ionizadas (electrolitos débiles o no electrolitos); el más común H2O.
2. Formación de un sólido insoluble, llamado precipitado (que se separa de la solución).
1. Reacciones ácido-base (de neutralización): formación de un no electrolito
La reacción de un ácido con un hidróxido metálico (base) produce sal y agua. Estas reacciones reciben el nombre de reacciones de neutralización, porque se neutralizan las propiedades de ácidos y bases.
En casi todas las reacciones de neutralización, la fuerza impulsora es la combinación de H+(ac) del ácido y OH–(ac) de la base para formar moléculas de agua.
2. Reacciones de Precipitación
Las reacciones que dan como resultado la formación de un producto insolubles se conocen como reacciones de precipitación.
Las reacciones de precipitación se efectúan cuando ciertos pares de iones con cargas opuestas se atraen entre sí con tal fuerza, que forman un sólido iónico insoluble.
Entre las nomenclaturas aceptadas, las más empleadas
son:
* Nomenclatura por Atomicidad: se utilizan prefijos que indican la atomicidad (número de átomos de cada clase) de los elementos que forman el compuesto: mono (uno), di (dos), tri (tres), tetra (cuatro), penta (cinco), hexa (seis), hepta (siete), octa (ocho), nona (nueve), deca (diez).
Ej. FeCl3 - Tricloruro de hierro.
* Nomenclatura por Numeral de Stock: se nombra el compuesto y en caso de que tenga más de un número de oxidación, (sin el signo) al final del nombre se agrega el número de oxidación entre paréntesis y en números romanos.
Ej. FeCl3 - Cloruro de hierro (III).
* Nomenclatura Tradicional: se utilizan prefijos y sufijos para especificar el número de oxidación del átomo central. Según el elemento tenga 1 o más e.o. los criterios que se adoptan son:
• Para elementos con un único e.o: no se agregan sufijos, o solo “ico”.
• Para elementos con dos e.o: para el menor estado se agrega el sufijo“oso”, mientras que para el mayor el sufijo “ico”.
• Para elementos con tres e.o: para el menor estado se agrega el sufijo“hipo” seguido del prefijo oso. Para el e.o. intermedio se usa el sufijo “oso”mientras que para el mayor se agregará el sufijo “ico”.
• Para elementos con cuatro e.o: para el menor estado se agrega el sufijo“hipo” seguido del sufijo oso. Para el siguiente e.o. se usa el sufijo “oso”, para el que sigue se agregará el sufijo “ico”, mientras que para el mayor se agregará el prefijo “per” seguido del sufijo “ico”.
Ej. FeCl3 - Cloruro férrico.
Bueno muchachos, es todo lo que tengo para compartir.
AVISO IMPORTANTE
El contenido del post es pura y exlusivamente material de la universidad a la que asisto, y no puedo poner en la fuente de información un link porque es algo que tengo en mi computadora y me mandan por mail, por lo que coloco que la información es de mi autoría AUNQUE NO LO ES, REPITO YO NO ESCRIBÍ TODO EL POST, por ahí puse algunas imágenes mejores a las que había. Es un PDF, el cual me tomé el trabajo de pasarlo aquí lo más prolijo posible para compartirlo con ustedes, ya que es lo mejor que hay para mi para estudiar este tema de química, ya que en internet la información está toda suelta y por ahí les cuesta más.
Gracias por pasarse, saludos!

0 comentarios